Modo de acción de genes supresores en tumores humanos
p53: EL GUARDIÁN DEL GENOMA
En una célula estresada la p53 libera los efectos
inhibidores de la MDM2 a través de dos mecanismos:
- Hipoxia y daño del ADN: Los principales iniciadores de la activación de p53 son dos proteínas cinasas relacionadas, la proteína mutada de la ataxia-telangiectasia (ATM) y la proteína de la ataxia-telagiectasia y Rad3 (ATR). Una vez activadas estimulan la fosforilación de una serie de proteínas, entre ellas p53 y MDM2, haciendo que se acumule p53.
- Estrés oncogénico: activación de oncoproteínas, como RAS, que da lugar a una señalización sostenida a través de vías del crecimiento como MAPK, PI3K/AKT. Estas señales generan estrés celular y uniéndose a MDM2 desplazando la p53 para elevarse.
Una vez activada, la p53 impide la transformación neoplásica al inducir una parada transitoria del ciclo celular, la senescencia o muerte celular programada (apoptosis).
La p53 se une al ADN con una secuencia específica y activa la transcripción de centenares de diferentes genes diana con elementos de unión a la p53. Los principales genes diana que ejecutan sus funciones pertenecen a tres categorías:
1. Los que detienen el ciclo celular
2. Los que producen apoptosis
3. Los que potencian el metabolismo catabólico o inhiben el metabolismo anabólico.
Una vez activado, se contempla el destino final de la célula afectada:
Cuando la p53 pierde su función, no se repara el daño del ADN, se acumulan mutaciones conductoras en los oncogenes y otros genes cancerosos, y la célula marcha a ciegas por una senda peligrosa que lleva a su transformación maligna al adquirir un fenotipo mutador.
RB: la gobernadora de la proliferación
Es un regulador negativo esencial
de la transición del ciclo celular G1/S1 que sufre una
inactivación directa o indirecta en la mayoría de los cánceres humanos. Su
estado es activo fosforilado en las células quiescentes e hiperfosforilado
inactivo en las que atraviesan la transición del ciclo celular G1/S1.
Su función se altera de dos formas:
1.Mutaciones con pérdida de la función de los dos
alelos RB
2.Desplazamiento
del estado hipofosforilado activo hacia el estado hiperfosforilado inactivo por
mutaciones con ganancia de la función que regulan el alza la actividad
CDK/ciclina D o por mutaciones con pérdida de la función que anulan la actividad
de los inhibidores de CDK.
3. Los altos niveles de complejos CDK4/ciclina D,
CDK6/cclina D y CDK2/ciclina E determinan una hiperfosforilación e inhibición
de la RB, liberandonse factores de trasncripción E2F que impulsan la expresión
de los genes requeridos para la progresión hasta la fase S
La pérdida del control normal del ciclo celular resulta esencial para
la transformación maligna y que, como mínimo, uno de los cuatro reguladores
esenciales del ciclo celular (p16/INK4a, ciclina D, DK4, RB) se encuentra
desregulado en la inmensa mayoría de los cánceres humanos.
Las proteínas transformantes de algunos virus ADN oncogenes animales y
humanos también actúan, en parte, neutralizando las actividades inhibitorias
del crecimiento de la RB, en estos casos la Rb se encuentra funcionalmente
inactivada por la unión de una proteína vírica y deja de actuar como inhibidora
del ciclo celular.
Otros genes supresores de tumores:
- APC:
Es
el gen de poliposis adenomatosa de colon, regula a las baja las señalizaciones
promotores del crecimiento, además forma parte de la via de señalización de WNT
la cual tiene como función el control del destino, adhesión y polaridad celular
en el desarrollo embrionario. La APC debe de regular la actividad de la
B-catenina, a falta de las señales de la vía WNT la APC degrada la B-catenina evitando
su acumulación en el citoplasma. Este proceso es mediante la formación del
complejo que produce la degradación proteosomica por el contrario la vía WNT
evita la formación de dicho complejo facilitando la translocación del
citoplasma al núcleo. Al llegar al núcleo la B catenina forma un complejo
activador de la transcripción con el factor FTC de unión al ADN, este complejo
formado induce al crcimiento de las células al aumentar la transcricion de
genes MYC y ciclina D1. Si se inactiva el gen APC el complejo destructor se
altera y como consecuencia la b catenina sobrevive y se trasloca al núcleo y
activa la transcripción de genes diana promotores del crecimiento.

- Cadherina E:
El
proceso eventual es que la B- catenina se una a la cola citoplasmática de la
cadherina E, sin embargo la perdida de contacto entre estas dos rompe la
interacción entre ellas y provoca mayor translocación de la B-catenina al
núcleo donde se estimula los genes de proliferación para reparar el daño. Por
el contrario, desde el punto de vista patológico puede haber una inhibición por
contacto que se asocia a una mutación del eje cadherina E/ B-catenina o a otro
cambio, lo cual se asocia a carcinoma. Por otro lado, la perdida de la
cadherina E ayuda al fenotipo maligno a facilitar la desagregación de las
células que invaden localmente o hacen metástasis. Se debe mencionar que la disminución de
expresión de la cadherina E en la superficie celular de algunos carcinomas a
causa de mutaciones del gen de la cadherina E ubicado en 16q o por efecto secundario de mutaciones
activadoras de genes de B catenina, así mismo
puede haber disminución de la
cadherina E por perdida de la función
del gen de la cadherina E.
- CDKN2A:
El
locus de este gen codifica las proteínas supresoras: inhibidor de la cinasa
dependiente de las ciclinas p16/INK4a que bloquea la fosforilación de la RB
mediada por CDK4/ciclina D y la p14/ARF que activa la via de p53 inhibiendo la
MDM2 e impidiendo la destrucción de p53. La mutación de este gen o el
silenciamiento causan alteraciones en las vías de supresión tumoral de la RB y
p53 que se asocian a carcinomas.

- Vía de TGF-B:
El
TGF-B es un gen potente de la inhibición de la proliferación que regula los
procesos celulares al unirse a los receptores I y II, al dimerizarse del
receptor desencadena señales intracelulares en las que intervienen proteínas de
la familia SMAD con lo que se obtiene que estas señales activen genes
antiproliferativos e inactivan genes estimuladores del crecimiento celular.
En
presencia de cáncer los efectos inhibitorios del crecimiento se alteran por
mutaciones con pérdida de la función de la via señalizadora del TGF-B. Entre
las mutaciones del gen TGF-B podemos mencionar las del receptor tipo II,
mutaciones de SMAD4.


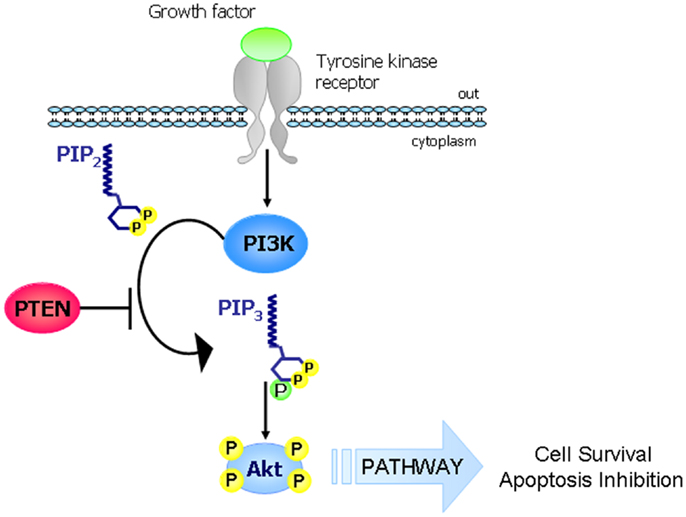
- PTEN:
Es
una fosfatasa asociada a la membrana codificada por un gen del cromosoma 10q23
y actua como supresora tumoral y con función de freno en la rama P13K/AKT de la
vía de los recpetores de la tirosina cinasa, sin embargo esta función se pierde
por la delación, mutaciones puntuales o silenciamiento epigenetico al estar
presente un proceso cancerígeno.

- NF1:
- NF2:
- WT1
- PTCHD:
- VHL:
- STK11:
Bibliografía:
1. Robbins, Cotrán RS, Kumar V, Abbas A, Fausto N, Aster J Patología estructural y funcional. 9ava ed. España: Elsevier Saunders; p. 290-299.
1. Robbins, Cotrán RS, Kumar V, Abbas A, Fausto N, Aster J Patología estructural y funcional. 9ava ed. España: Elsevier Saunders; p. 290-299.




Comentarios
Publicar un comentario