Mecanismos
PROTOONCOGENES
Los protooncogenes son genes que promueven el crecimiento y la
proliferación. Participan en las vías de señalización que impulsan a la
proliferación, favoreciendo el crecimiento mediante codificación de factores de
crecimiento, transductores de señal, factores de transcripción o componentes
del ciclo celular. Cualquier mutación de éstos puede resultar en variantes
alteradas u oncogenes, que codifican proteínas que desencadenen señales
positivas de proliferación mantenida, que mantiene a las células estimuladas
para seguir proliferando.

Los
protooncogenes promueven el crecimiento y proliferación celular. Las
mutaciones en éstos pueden alterar las funciones normales, induciendo a la
célula a mantenerse en un estado de supervivencia celular prolongada, dando
lugar a neoplasias.
|
Los protooncogenes producen diversos productos proteicos con
diferentes funciones dentro de la célula; pueden ser factores de crecimiento
como el factor de crecimiento epidérmico (EGF) y el factor de crecimiento
derivado de plaquetas (PDGF), o receptores de membrana como el receptor del
factor de crecimiento epidérmico (EGF-R). La célula interpreta la señal y envía
segundos mensajeros, mediante transductores de señal, que pueden alterar la
transcripción, modificando los niveles de expresión de genes ya activados,
valiéndose de los factores de transcripción.
Los protooncogenes pueden activarse por mutaciones puntuales. Las
mutaciones puntuales de la familia RAS es el caso más común que activa a los
protooncogenes en los tumores humanos. Existen tres genes RAS: HRAS, KRAS y
NRAS. Las proteínas RAS son miembros de una familia de proteínas G asociadas a
la membrana que se unen a GTP y GDP. Cuando se encuentran unidas a GTP, adoptan
un estado excitado; cuando se encuentran unidas a GDP entran en un estado quiescente.
La estimulaciones de receptores de tirosina cinasa por los factores de
crecimiento determinan un cambio de GDP a GTP, lo que activa la proteína RAS,
la cual estimula las ramas MAPL y PI3K/AKT de la vía señalizadora de receptores
de tirosina cinasa. Las cinasas de la cascada fosforilan y activan una serie de
efectores citoplasmáticos y factores de transcripción, que activan genes que
favorecen el crecimiento celular rápido. La activación de la RAS es transitoria
por su actividad GTPasa intrínseca, que se ve acelerada por proteínas
activadoras de la GTPasa, que se unen a la RAS activa y escinden el GTP a GDP,
terminando con la traducción de la señal.
Las mutaciones puntuales de RAS en células cancerosas reducen la
actividad GTPasa de la proteína RAS, lo que las mantiene en forma permanente en
estado activado, unido a GRP, por lo que la célula recibe constantemente
señales para crecer y proliferar. Al mismo tiempo, existen mutaciones que
pierden la función de las proteínas activadoras de la GTPasa.

Las
mutaciones puntuales de RAS reducen la actividad GTPasa de la proteína RAS,
manteniéndose en un estado activado permanente, lo que envía señales
constantes de crecimiento y proliferación.
|
El protooncogen MYC es expresado en todas las células eucariotas y
pertenecen a los genes de respuesta precoz inmediata, que son inducidos de
forma pasajera por señalización RAS/MAPK después de la estimulación por
factores de crecimiento en las células quiescentes. Los polimorfismos de un
solo nucleótido en el cromosoma 8 alteran la función de los elementos
potenciadores que regulan la expresión de MYC. Se desconoce cómo MYC fomenta el
crecimiento normal y neoplásico de la célula, pero existen evidencias que
indican que la expresión de MYC desregula el crecimiento celular; activa genes
que contribuyen al crecimiento celular, como la ciclinas D, el alza de
expresión de genes del ARNr y la reprogramación metabólica; regula al alza la
expresión de la telomerasa, lo que le da una capacidad de replicación
interminable a las células cancerosas; y reprograma las células somáticas hacia
células madre pluripotenciales.
ONCOGENES
¿Qué es un oncogén?
Son los genes que fomentan el crecimiento celular autónomo de las células cancerosas; por lo que el proceso por el cual los protooncogenes se alteran constituye el mecanismo de activacion de oncogenes. Estos se producen por mutaciones de los protooncogenes y codifican proteínas, denominadas oncoproteínas, que inducen el crecimiento celular sin que exista la señal normal correspondiente.
Las oncoproteínas son de aspecto similar a los productos normales de los protooncogenes, sin embargo estos portan mutaciones que, inactivan los elementos reguladores internos, por lo que no dependen de señales externas.
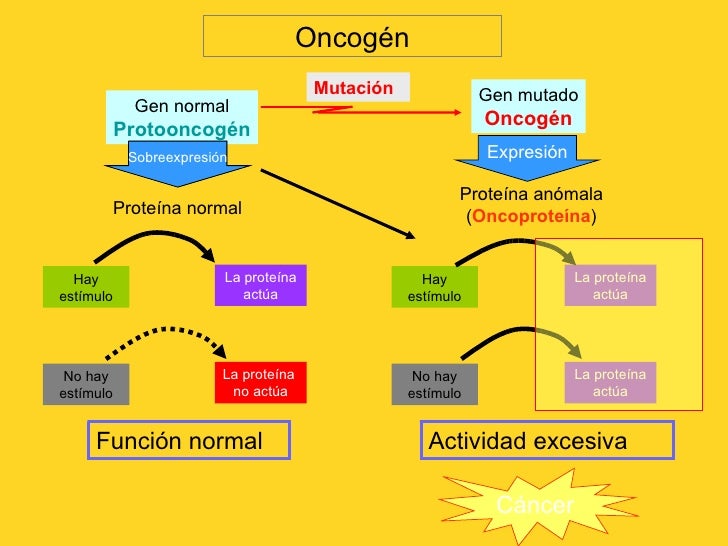
ONCOPROTEÍNAS
ONCOGENES
¿Qué es un oncogén?
Son los genes que fomentan el crecimiento celular autónomo de las células cancerosas; por lo que el proceso por el cual los protooncogenes se alteran constituye el mecanismo de activacion de oncogenes. Estos se producen por mutaciones de los protooncogenes y codifican proteínas, denominadas oncoproteínas, que inducen el crecimiento celular sin que exista la señal normal correspondiente.
Las oncoproteínas son de aspecto similar a los productos normales de los protooncogenes, sin embargo estos portan mutaciones que, inactivan los elementos reguladores internos, por lo que no dependen de señales externas.

Los oncogenes son producidos por las mutaciones que se llevan en un protooncogen, las cuales predisponen a formar células cancerígenas.
En su mayoría,
todos los oncogenes actúan como genes dominantes o expresivos; si la célula
tiene un gen normal, protooncogen, y uno mutado, que es el oncogen, es el que
se desarrolla. Basta con la presencia de un solo oncogen para producir cáncer.
Esto lo realiza a manera en que se incrementa la tasa de mitosis celular. Esto
es consecuencia, a que al existir un incremento de la división celular, aumenta
el riesgo de adquirir mutaciones, debido a que un clon de las células en
división, puede producir subclones con un segundo oncogen, entonces cuando un
clon ha acumulado varios oncogenes activos, pierde todo control sobre la
mitosis y el clon donde se desarrolla, convirtiéndose en cáncer.
Basta con la
presencia de un solo oncogen para producir cáncer. Esto lo realiza a
manera en que se incrementa la tasa de mitosis celular. Esto es consecuencia, a
que al existir un incremento de la división celular, aumenta el riesgo de
adquirir mutaciones, debido a que un clon de las células en división, puede
producir subclones con un segundo oncogen, entonces cuando un clon ha acumulado
varios oncogenes activos, pierde todo control sobre la mitosis y el clon donde
se desarrolla, convirtiéndose en cáncer.
Estas mutaciones o alteraciones celulares son producidas específicamente en
ciertos grupos de genes conocidos, estimulando la proliferación celular
por medio de la inhibición de los mecanismos de control de la división
celular; tal es el caso de:
- Mutaciones de los receptes de factores de crecimiento.
- Mutaciones de Ras (anomalía más común).
- Mutaciones de BRAF y PI3K.
- Mutaciones de la tirosina cinasa no asociada a receptores.
- Mutaciones con ganancia de la función de los genes de ciclina D y CDK4.
- Mutaciones con perdida de la función de los genes supresores de tumores que inhiben G1/S.
Los oncogenes
estimulan la proliferación celular evitando los mecanismos de control de la
división celular. Otro grupo de genes que se alteran en el desarrollo del
cáncer son los genes supresores de tumores que codifican proteínas inhibidoras
del ciclo celular. La pérdida de la función supresora de este tipo de genes
suele requerir la alteración de los dos alelos que codifican la proteína
inhibidora.
Genes Supresores de Tumores
|
||||
Gen
|
Proteína
codificada
|
Función
|
Enfermedades
familiares
|
Neoplasias
|
Inhibidores de las
vías señalizadoras mitógenas
|
||||
APC
|
Proteína de la poliposis adenomatosa del
colon
|
Es el guardián de la
neoplasia del colon. Regula las vías señalizadoras promotoras del crecimiento
y mediante la inhibición de la señalización WNT controla el destino, adhesión
y polaridad celulares durante el desarrollo embrionario
|
Poliposis
adenomatosa familiar: múltiples pólipos en el colon
|
Cáncer de colon
|
NF1
|
Neurofibromina 1
|
La neurofibromina contiene un dominio
activar de GTPasa que bloquea la señalización RAS
|
Neurofibromatosis de tipo 1: neurofibromas y
gliomas del nervio óptico
|
Neuroblastoma
|
NF2
|
Neurofibromina 2 o merlina
|
Proporciona
estabilidad citoesquelética, mediante inhibición de a señalización por la vía
Hippo
|
Neurofibromatosis de
tipo 2: schwannomas bilaterales del nervio acústico
|
Schwannomas
|
PTCH
|
Patched1
|
Las proteínas PATCHED son reguladoras
negativas de la via de señalización Hedgehog.
|
Síndrome de Gorlin
|
Carcinoma basocelular y meduloblastoma
|
PTEN
|
Homólogo de fosfatasa y tensina
|
PTEN actúa como
supresor tumoral mediante la inhibición en la rama PI3K/AKT de la vía de los
receptores de la tirosina cinasa.
|
Síndrome de Cowden:
tumores benignos frecuentes
|
Canceres epiteliales
(cáncer de mama)
|
SMAD2 y
SMAD4
|
SMAD 2 y SMAD4
|
Son componentes de la via de señalización
TGF-beta, donde desencadena señales que activan genes antiproliferativos e
inactivan genes estimuladores del crecimiento celular.
|
Poliposis juvenil
|
El gen mutado está presente en cáncer de
colon y páncreas
|
Inhibidores de la progresión del ciclo celular
|
||||
RB
|
Proteína del retinoblastoma
|
Inhibición de la transición G1/S durante la
progresión del ciclo celular.
|
Síndrome familiar de retinoblastoma
|
Retinoblastoma; osteosarcoma, carcinoma de
mama, ccolon y pulmón.
|
CDKN2A
|
p16/INK4a y p14/ARF
|
p16: regulador
negativo de las cinasas dependientes de ciclinas
p14: activador
indireto de p53.
|
Melanoma familiar
|
Carcinoma de
páncreas, mama, esófago, melanoma y ciertas leucemias.
|
Inhibidores de los programas “procedimiento” de
metabolismo y angiogenia
|
||||
VHL
|
Proteína de von Hippel Lindau (VHL)
|
Inhibición de los
factores de transcripción inducidos por la hipoxia.
|
Síndrome von Hippel
Lindau (hemangioblastoma cerebeloso, angioma de retina, carcinoma de células
renales).
|
Carcinoma de células
renales.
|
STK11
|
Cinasa hepática B1 (LKB1) o STK11.
|
Activación de la familia de cinasas AMPK;
suprime el crecimiento celular cuando escasean los nutrientes celulares y la
energía.
|
Síndrome de Peutz-Jeghers (pólipos y
cánceres del tubo digestivo, carcinoma pancreático
|
Diversidad de carcinomas. Algunos de los
cuales dependen del tipo.
|
SDHB y SDHD
|
Subunidades B y D del complejo succinato
deshidrogenasa.
|
Ciclo del ácido
tricarboxílico, fosforilación oxidativa.
|
Paraganglioma
familiar, feocromocitoma familiar.
|
Paraganglioma
|
Inhibidores de la invasión y metástasis
|
||||
CDH1
|
Cadherina E
|
Adhesión celular,
inhibición de la motilidad celular.
|
Cáncer gástrico
familiar
|
Carcinoma gástrico,
carcinoma lobulillar de mama.
|
Potenciadores de la estabilidad genómica
|
||||
TP53
|
Proteína p53.
|
Parada del ciclo
celular, inhibición de la motilidad celular.
|
Síndrome de
Li-Frumeni (diversos cánceres)
|
Mayoría de cánceres
humanos.
|
Factores de reparación de ADN
|
||||
BRCA1 y
BRCA2
|
Cáncer de mama 1 y cáncer de mama 2.
|
Reparación de las
roturas de la doble hebra de ADN.
|
Carcinoma familiar
de mama y ovario, carcinoma de mama masculino; leucemia linfocítica crónica
(BRCA2).
|
Rara
|
MSH2,
MLH1 y MSH6
|
MSH1, MLH1, MSH6.
|
Reparación de los errores en el
emparejamiento de las bases de ADN.
|
Carcinoma hereditario de colon no asociado a
poliposis
|
Carcinoma de colon y endometrio.
|
Mecanismos desconocidos
|
||||
WT1
|
Tumor de Wilms 1
|
Factor de transcripción.
|
Tumor de Wilms familiar
|
Tumor de Wilms, algunas leucemias.
|
MEN1
|
Menina
|
Factor de
transcripción
|
Neoplasia endocrina múltiple
1 (MEN 1: tumores endocrinos hipofisiarios, paratiroideos y pancreáticos)
|
Tumores endocrinos
hipofisiarios, paratiroideos y pancreáticos.
|
Comentarios
Publicar un comentario